|
Inhaltsübersicht | Nanomaschinen | Moleküle | Programme | Kurse | Fun | Links |
||
| > |
Gleichgewichtskonstante der Lactatdehydrogenase-Reaktion
Bei der Pyruvatbestimmung in Exp. 6.2. wurde die Annahme gemacht, dass das thermodynamisch gegebene Gleichgewicht der Reaktion von Pyruvat zu Lactat unter den gegebenen Bedingungen ganz rechts liegt (siehe Reaktionsgleichung Exp. 6.2). Dies wird nun durch die Bestimmung der Gleichgewichtskonstanten nachgewiesen.
Prinzip
Da die Reaktion von Pyruvat zu Lactat reversibel ist, wird bei genügend hohen Konzentrationen von Lactat und NAD+ Pyruvat und NADH in messbaren äquimolaren Mengen gebildet. Das gebildete NADH wird durch Messung der Extinktion bei 340 nm bestimmt. Die Reaktion wird bis zum Erreichen des Gleichgewichts verfolgt, d.h. bis die Extinktion konstant bleibt. Bei bekannten Anfangskonzentrationen der Substrate und bei konstant gehaltener H+-Konzentration können die Konzentrationen aller Reaktionspartner im Gleichgewicht berechnet werden. Die Gleichgewichtskonstante ist
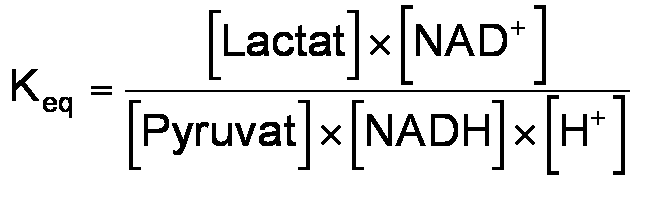
Lösungen
- Natriumlactat, 250 mM, in Na-Phosphat Puffer, pH 8.0
- NAD+, 4 mM, in Na-Phosphat, pH 8.0
- Na-Phosphat Puffer (50 mM), pH 8.0
Lactatdehydrogenase (LDH, ca. 100 µg/ml)
Wasser
Ausführung
In zwei Küvetten die folgenden Lösungen pipettieren (ml):
|
Lösung |
Kontrolle |
Probe |
|
250 mM Na-Lactat |
2.0 |
2.0 |
|
4 mM NAD+ |
0.2 |
0.2 |
|
Na-Phosphat pH 8.0 |
0.25 |
0.25 |
|
H2O |
0.05 |
- |
|
LDH |
- |
0.05 |
Gut mischen und mit Kontrolle sofort Extinktion bei 340 nm auf Null abgleichen. Zuerst die Kontrolle ansetzen, erst dann die Probe.
Probenküvette einsetzen. Zunahme der Extinktion in Intervallen von genau 3 Min ablesen, bis die Extinktion nicht mehr weiter steigt (nach ca. 15 Min).
Der molare Extinktionskoeffizient von NADH bei 340 nm beträgt 6220 M-1 cm-1. Zuerst die Anfangskonzentrationen aller Reaktionspartner in der Küvette berechnen. Nach Erreichen des Gleichgewichts aus der Extinktionszunahme bei 340 nm die Konzentration von gebildetem NADH bestimmen und daraus und aus den Anfangskonzentrationen die Konzentrationen von Pyruvat, NAD+ und Lactat berechnen. Durch den Puffer wird der pH-Wert konstant gehalten. Aus den Werten die Gleichgewichtskonstante nach (1) berechnen.
Die Ansätze in den beiden Küvetten werden im nächsten Versuch weiterverwendet!
|
Konzentration |
[Lactat] |
[NAD+] |
[Pyruvat] |
[NADH] |
[H+] |
|
Anfang |
... |
... |
... |
0 |
10-8 |
|
im Gleichgewicht |
... |
... |
... |
... |
... |
Keq = ..............
Fragen
- Typische Konzentrationen im Erythrozyt sind 2.9 mM für Lactat, 0.05 mM für Pyruvat und der intrazelluläre pH-Wert ist rund 7.2. Da der Erythrozyt genügend LDH enthält, um die Konzentrationen der Reaktionspartner sehr nahe am Reaktionsgleichgewicht (Keq) zu halten, lässt sich das Verhältnis von NAD+/NADH im Erythrozyt abschätzen. Wieviel kann dieses betragen?