|
Inhaltsübersicht | Nanomaschinen | Moleküle | Programme | Kurse | Fun | Links |
||
| > |
Aktivierung von Chymotrypsinogen
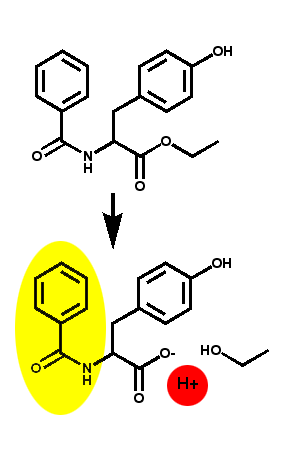 |
PrinzipTrypsin aktiviert Chymotrypsinogen durch spezifische Proteolyse zu Chymotrypsin. Das aktivierte Chymotrypsin katalysiert die Hydrolyse des Modellsubstrates N-Benzoyl-L-tyrosinethylester. Die entstehende Karbonsäure N-Benzoyl-L-tyrosin wird mit einem pH-Indikator nachgewiesen. |
Lösungen
- 4 mM Tris-HCl pH 9.0 (Tris = Tris-(hydroxymethyl)aminomethan, eine Puffersubstanz für den pH-Bereich 7 - 9)
- 8 mM N-Benzoyl-L-tyrosinethylester in 50 % Methanol
- Phenolrot als Indikator (sauer: gelb; alkalisch: rot; pKa = 7.9)
- 20 µg/ml Chymotrypsinogen
- 20 µg/ml Trypsin
Ausführung
4 RG vorbereiten und folgende Komponenten zugeben:
|
Ansätze |
A |
B |
C |
D |
|
Tris-HCl |
1 ml |
1 ml |
1 ml |
1 ml |
|
Tyrosinester |
1 ml |
1 ml |
1 ml |
1 ml |
|
Wasser |
1 ml |
0.5 ml |
0.5 ml |
- |
|
Phenolrot |
1 Tr. |
1 Tr. |
1 Tr. |
1 Tr. |
|
Chymotrypsinogen |
- |
0.5 ml |
- |
0.5 ml |
|
Trypsin |
- |
- |
0.5 ml |
0.5 ml |
Inhalt gut mischen; RG ins 40oC-Wasserbad stellen und Farbänderungen beobachten. (Proben müssen am Anfang rötlich gefärbt sein, andernfalls muss der Versuch mit frischer Tris-Lösung wiederholt werden.) Farbe nach Ablauf von 5 min feststellen und Ergebnisse in Tabelle eintragen. Allfällige spätere Farbveränderungen beobachten und notieren.
|
Farbe
|
|
| A Kontrolle | |
| B Chymotrypsinogen | |
| C Trypsin | |
| D Chymotrypsinogen+ Trypsin |
Fragen
- Wozu dient die Benzoylgruppe im Modellsubstrat?
- Warum werden Enzyme als Zymogene synthetisiert?
- Welche Möglichkeiten könnte es für die Aktivierung eines ersten Zymogens einer Enzymkaskade geben?
- Warum wird die Aktivität von Proteasen mit Estersubstraten getestet?